Top Research
Gezamenlijk onderzoek bij de afdeling Humane Genetica Amsterdam UMC resulteerde in 327 publicaties in 2021. Hieronder worden twee wetenschappelijke publicaties met een hoge impact uitgelicht.
Een Nieuwe Rol voor Dynamine bij Neuronsignalering
SECTIE: FUNCTIONAL GENOMICS

Langdurige modulatie
Neurotransmitters zijn chemische berichten die worden verzonden naar een naburig neuron voor snelle overdracht van een signaal. Neuropeptiden richten zich op een groep neuronen of orgaancellen die specifieke receptoren hebben. Neuropeptiden werken meer indirect, vooral als een cascade van overdracht signalen betrokken is, maar en hebben een langdurig effect.hebben
Vergeleken met neurotransmitters is er veel minder bekend over hoe neuropeptiden worden georganiseerd en afgegeven. Mensen hebben een divers repertoire aan verschillende neuropeptiden, met meer dan 100 bekende en op basis van genoomanalyse 1000 verwachte. Ze regelen veel fysiologische functies zoals hersenontwikkeling, synaptische plasticiteit, circadiaans ritme, gedrag en emoties. Defecten in hun signaal overdracht worden geassocieerd met meerdere psychiatrische stoornissen, obesitas en diabetes.
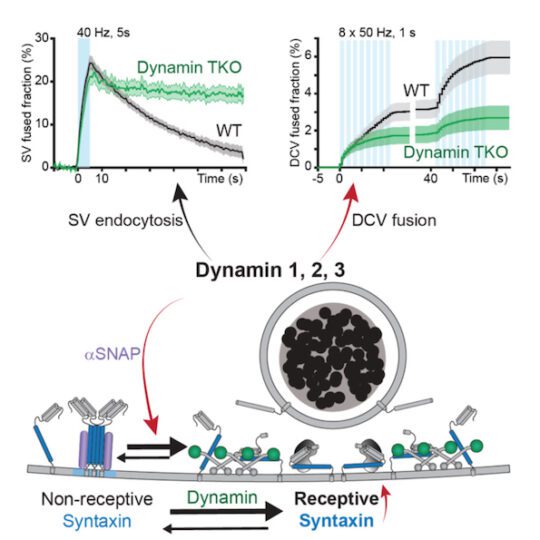
Een nieuwe rol voor dynamine
Dr. Alessandro Moro, Anne van Nifterick, dr. Ruud F. Toonen en prof. dr. Matthijs Verhage, van het Centre for Neurogenomics and Cognitive Research van de afdeling Humane Genetica, publiceerden de ontdekking dat het eiwit dynamin een centrale regulator is voor de secretie van neuromodulatoren uit dichte kern blaasjes in zoogdier neuronen. De studie, gepubliceerd in Science Advances in mei 2021, onthult een verrassende nieuwe rol voor dynamin, waarvan bekend was dat het betrokken was bij het in de cel brengen van dichte kern blaasjes (endocytisch), maar niet om ze ook uit te zenden (exocytose).
Dr. Alessandro Moro legt uit: “Mensen hebben drie soorten dynamins. Genetische of farmacologische inactivatie van alle drie de dynamines verminderde de exocytose van de dichte kern blaasjes sterk, maar had geen invloed op het andere synaptische vesikelroute. Wildtype dynamin herstelde normale exocytose, maar GTPase-deficiënte of membraanbindende mutanten die neurologische ontwikkelingssyndromen veroorzaken deden dat niet.'
De auteurs stellen voor dat de nieuw ontdekte rol van dynamin uniek is vanwege zijn goed gekarakteriseerde rol bij endocytose. 'Dynamines lijken twee cruciale rollen te spelen bij exocytose van dichte kern blaasjes: ze organiseren de vesikel-fusie-plaatsen en herstellen of reactiveren fusie-plaatsen voor herhaald gebruik.'
Deze inzichten dragen bij aan de huidige kennis van de biologische mechanismen die ten grondslag liggen aan sommige neurologische ontwikkelingssyndromen.
Ontdekking van Nieuwe Genen in DNA -Schadeherstel met CRISPR
SECTIE: ONCOGENETICA
Onderzoekers Klaas de Lint en Dr. Rob Wolthuis introduceerden een genoom-brede CRISPR screeningopzet in Cas9-induceerbare diploïde cellen om genen te identificeren die betrokken zijn bij DNA-schade respons. In samenwerking met het Dr. Martijn Luijsterburg laboratorium (LUMC) richtten ze zich eerst op het identificeren van de menselijke genen die betrokken zijn bij het proces van Transcription Coupled DNA Repair. Hun ontdekkingen werden in juni 2021 gepubliceerd in Nature Cell Biology .

Met de Nobelprijswinnende toepassing van CRISPR-technologie in menselijke cellen, werd het onlangs voor onderzoekers mogelijk om systematisch menselijke genen in in het laboratorium gekweekte cellen te ontwrichten om hun rol in kankerrelevante biologische processen te onthullen.
ELOF1 is vooral belangrijk om cellen te helpen omgaan met UV--straling en chemotherapeutische medicijnen, maar speelt ook een rol bij gecontroleerde celdeling. Deze bevindingen vergroten ons begrip van erfelijke kankersyndromen die verband houden met DNA-schadeherstelgenen, evenals de effecten van gerichte medicijnen die worden gebruikt bij kankertherapie.
Het Wolthuis-lab implementeerde een nieuwe pijplijn voor zogenaamde gepoolde lentivirale full-genome CRISPR-Cas9 knock-out screening. Een verzameling van 71.000 verschillende CRISPR-lentivirussen werd gebruikt om een populatie van miljoenen cellen te creëren, elk met een knock-out van een uniek menselijk gen. Vervolgens is gemeten welke genen essentieel zijn voor celgroei en overleving, voor of na behandeling met een specifiek DNA-beschadigend medicijn. Daardoor konden de onderzoekers de menselijke genen en paden lokaliseren die betrokken zijn bij de onderliggende DNA-reparatieroute van deze studie, genaamd Transcription-Coupled DNA Repair (TCR).
Afgezien van alle bekende TCR-genen, werd het voorheen niet-gekarakteriseerde ELOF1 - gen geïdentificeerd als een tophit. Vervolgens werd een breed scala aan experimentele benaderingen gebruikt, waaronder follow-up drugscreens in isogene cellijnen, om de precieze functie van ELOF1 op te helderen. De onderzoekers ontdekten dat ELOF1 -een nieuw onderdeel is van de mRNA-synthese-machinerie (het RNA-polymerase II-complex), maar ook een belangrijke factor is bij DNA-herstel, wanneer het RNA-polymerase II-complex een transcriptie-blokkerende laesie tegenkomt.
Lees de publicatie: Van der Weegen, Y., De Lint, K., Van den Heuvel, D. et al. (2021) ELOF1 is a transcription-coupled DNA repair factor that directs RNA polymerase II ubiquitylation. Nat. Cell Biol. 23, 595–60.https://doi.org/10.1038/s41556-021-00688-9